肿瘤发病和死亡情况异常严峻,其精准治疗不容忽视,因此近年来各类肿瘤机制研究和创新疗法开发的热度居高不下。作为衔接基础研究与临床应用的关键环节,肿瘤动物模型在解析肿瘤发生、发展、转移机制以及药物研发与评估中发挥着至关重要的作用。
肿瘤药效研究
抗肿瘤药物药效学评价是小动物光学成像技术的基础应用之一,利用荧光素酶标记肿瘤细胞,并移植入动物体内建立肿瘤疾病动物模型,给药后应用小动物活体光学成像技术观测肿瘤光学信号随时间的变化情况,进而评价不同药物、特定的给药途径、时间、剂量等给药策略对于肿瘤的治疗效果。
相较于分批处死动物以获取实验数据的传统方法,活体成像技术利用细胞和分子水平的定性定量研究进行观测记录,在构建原位成瘤CDX模型相关研究过程中,更便于跟踪疾病进展及肿瘤转移情况,使得肿瘤模型的动态监测不似以往受限。
实验流程方法
01
确定使用的萤光素酶
常见的萤光素酶有萤火虫萤光素酶(Firefly luciferase,Fluc),海肾萤光素酶(Renilla luciferase,Rluc),Gaussia萤光素酶。它们在特定的条件下都可以催化各自的底物发出对应的光,这个过程无需激发器激发。其中,Fluc是使用最广泛的萤光素酶。
02
构建稳定表达萤光素酶的细胞株
将带有Fluc基因的载体通过转染试剂等方法以一定手段转入研究的肿瘤细胞中,并通过筛选得到稳定表达Fluc的稳转细胞株。
03
皮下成瘤或原位成瘤
成功构建稳转株后,即可进行动物移植模型构建。此时一般是将Fluc细胞注射到小鼠体内。
常见的实验操作如下:
1. 准备对数期生长的、细胞密度达80 - 90%左右的Fluc肿瘤细胞。
2. 将细胞悬液和Ceturegel™基质胶在4℃环境下按1:1比例进行稀释。
3. 左手抓取固定裸鼠,于裸鼠右肩处皮下注射.
04
活体成像观测
细胞接种一段时间后,可以进行活体成像检测。首先麻醉实验动物, 接着注射底物荧光素,最佳的检测时间是在注射后10 - 15 min之间。但需要注意的是,对于不同的动物模型,发光动力学过程并不完全一致,最好先进行预实验。
结果展示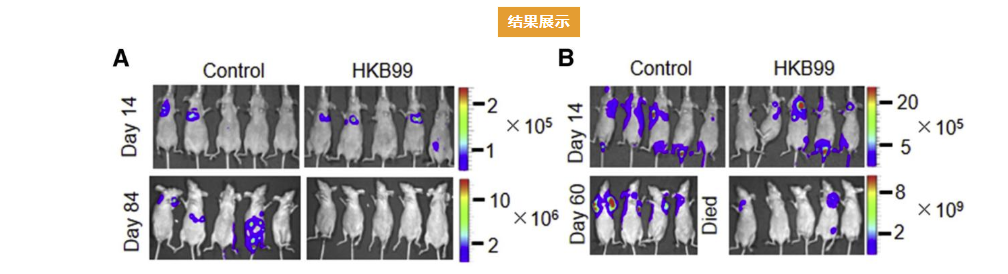
注:探究抗肿瘤药物HKB99对肿瘤生长及转移的影响。(DOI: 10.1016/j.cmet.2019.09.014 )
产品详情
|
产品名称 |
货号 |
规格 |
|
40183ES08/10 |
5 mL/10 mL |
|
|
40901ES01/02/03/08 |
100 mg/500 mg/1 g/5 g |
|
|
40902ES01/02/03/09 |
100 mg/500 mg/1 g/5 g |
|
|
40903ES01/02/03 |
100 mg/500 mg/1g |
|
|
40904ES02/03/08 |
1×500 μg/2×500 μg/5 mg |
|
|
40905ES02/03 |
1×500 μg/2×500 μg |
|
|
40906ES02/03/08 |
1×500 μg/2×500 μg/5 mg |
|
|
40908ES02/03 |
1×500 μg/2×500 μg |
